«Салициловая кислота»
Салициловая кислота в словарях и энциклопедиях

Источники
- Словарь Брокгауза и Ефрона
- Большая Советская энциклопедия
- Большой энциклопедический словарь
- Большой англо-русский и русско-английский словарь
- Англо-русский словарь технических терминов
- Научно-технический энциклопедический словарь
- Биологический энциклопедический словарь
- Химическая энциклопедия
- Энциклопедический словарь
- Русско-английский политехнический словарь
- Dictionnaire technique russo-italien
- Естествознание. Энциклопедический словарь
- Большой Энциклопедический словарь
- Источник: Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
- Источник: Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Источник: Большой Энциклопедический словарь. 2000.
- Источник: Большой англо-русский и русско-английский словарь
- Источник: Англо-русский словарь технических терминов
- Источник: Научно-технический энциклопедический словарь
- Источник: Химическая энциклопедия
- Источник: Энциклопедический словарь
- Источник: Русско-английский политехнический словарь
- Источник: Dictionnaire technique russo-italien
- Источник: Естествознание. Энциклопедический словарь
- САЛИЦИЛОВАЯ КИСЛОТА
- САЛИЦИЛОВАЯ КИСЛОТА (орто-гидроксибензойная кислота) - С6Н4(ОН)СООН; бесцветные кристаллы, tпл159 .С. Применяют в производстве красителей, лекарственных и душистых веществ, в пищевой промышленности (при консервировании), медицине (как наружное средство антисептического, раздражающего, кератолитического действия), как аналитический реагент.
- Источник:
Словарь Брокгауза и Ефрона
(хим.) С7Н6О3= С6Н4(ОН)—СО2Н — является представительницей ароматических оксикислот. С. кислота в виде соединений со спиртами (эфиров) часто встречается в растительном царстве; так, ее эфиры находятся в цветах Spirea ulmaria, в эфирном масле Gaulteria procumbens и некотор. вересковых (Ericaceae). Открыта она была Пириа 1838 г. Этот химик, исследуя продукты распада салицина, глюкозида, находящегося в корнях и листьях Salix helix, выделил салициловый альдегид C6H4(OH)CHO, который при сплавлении с едким кали, подобно всем альдегидам, распался на кислоту, которую он и назвал салициловой, и соответствующий спирт — салигенин (см.). Через год после этого открытия Лёвиг и Видеман открыли С. кислоту в цветах Spirca ulmaria, а в 1843 г. Кагур показал, что главная составная часть гаултерового масла есть С.-этиловый эфир С6Н4(ОН)—СО2С2Н5. Исследования этих ученых касались гл. образом констатирования присутствия С. кисл. в тех или других продуктах растительного царства, и они совершенно не касались строения С. кислоты, которую просто принимали за двухосновную кислоту, и только благодаря трудам Gerhardt'a (1853 г.) и Кольбе (1860 г.) возможно было установить рациональную формулу С. кислоты, которая теперь рассматривается как ортооксибензойная кислота, Кольбе же первый и синтезировал С. кисл., открыв при этом довольно общий способ получения ортооксикислот ароматического ряда. Этот ученый показал, что феноляты натрия способны фиксировать при высокой темп. угольный ангидрид и превращаться при этом в натровые соли ортооксикислот:
2C6H5ONa + CO2= C6H4(ONa)CO2Na+C6H5(OH).
Замечательно, что эта реакция идет только с фенолятами натрия, другие же металлы дают в этом случае соли метаоксикислот. Теперь этот способ получения С. кислоты приобрел громадное значение в технике, и вся С. кислота готовится по нему, и только сравнительно очень недавно в технику начал проникать способ получения С. — Р. Шмитта, который показал, что при большом давлении фенолят натрия соединяется с угольным ангидридом на холоде, давая фенолоуглекислый натр C6H5O—CO2Na, т. е. натровую соль кислого фенилугольного эфира , которая в свою очередь под давлением и при 120—130° нацело превращается в салицилово-натриевую соль. Салициловая кислота кристаллизуется бесцветными иголками сладковато-кислого вкуса. Она довольно трудно растворима в холодной воде и легко в горячей и спирте. Ее водные растворы с хлорным железом дают характерное, очень интенсивное фиолетовое окрашивание. Как оксикислота, она способна со спиртами давать два ряда эфиров, кислые и средние, напр. C6H4(OH)CO3CH2и С6Н4(ОСН3)СО2СН3. Кроме того, средние эфиры при неполном обмыливании едким кали дают эфирокислоты, напр. С6Н4(ОСН3)—СО2СН2+ KHO = С6Н4(ОСН3)СО2К + СН3ОН. Из вышеприведенных производных имеют значение главным образом кислые эфиры, легко получаемые кипячением С. кислоты с соответствующим спиртом в присутствии серной кислоты или при пропускании через кипящую смесь С. кислоты со спиртом сухого хлористоводородного газа. Кислый метильный эфир С6Н4(OH)CO2CH3известен в продаже под названием гаултерового масла (Wintergrünol); это — жидкость удельн. веса 1,197, кипящая при 224°, обладает приятным запахом, несколько напоминающим гиацинты. При нагревании С. кислоты с фенолом и хлорокисью фосфора POCl3образуется кислый фенильный эфир С6Н4(ОН)CO2—С6Н5, известный под названием салола (см.). Если вместо фенола взять тиофенол, то получается тиосалол С6Н4(OH)CO—S—C6H5— хорошее антисептическое средство. При нагревании одной С. кислоты или в присутствии водоотнимающих средств образуются разнообразные продукты уплотнения ее и между прочим ксантон
хромогенное вещество многих желтых красок.
Д. А. Хардин. Δ.
С. кислота — врачебное применение. Белый, объемистый порошок или мельчайшие, блестящие, игольчатые кристаллы, без запаха, сладковато-кислого, раздражающего вкуса, растворяется в 500 чч. холодной и в 15 чч. горячей воды, в 2,5 ч. спирта, 2 ч. эфира, 80 ч. хлороформа, 60 ч. глицерина, 70 ч. жирного масла; плавится при 157°. С. кислота одно время добывалась из коры некоторых видов ивы (Salix — откуда и название этой кислоты).
Салицилокислый натрий — белый кристаллический порошок, растворяется в 0,9 част. воды, в 6 ч. алкоголя, содержит 14,38 % натрия и 85,62 % частей С. кислоты. С. кислота и ее натриевая соль нашли широкое применение во врачебной практике начиная с конца 70 годов, когда обращено было внимание на весьма успешное лечение этими препаратами острого суставного ревматизма. Благоприятные результаты при таком заболевании, против которого не было до того времени сколько-нибудь надежных средств, послужили толчком к введению в терапию целой серии новых препаратов, нашедших широкое практическое применение и немало способствовавших разъяснению некоторых весьма важных вопросов патологии, терапии и фармакологии. Так как острый суставный ревматизм вызывается болезнетворным микроорганизмом (хотя точно до сих пор не определенным) и характеризуется главным образом повышением температуры тела и ощущением боли в суставах, то С. кислота, устраняя такое заболевание, должна, следовательно, действовать на самую причину болезни или же, кроме того, на явления, сопутствующие заболеванию, а именно парализовать болевую чувствительность и понизить повышенную температуру. Ввиду этого фармакологическое исследование имеет целью изучение антисептических, жаропонижающих и болеутоляющих свойств С. кислоты и вместе с тем ознакомление с другими сторонами действия этих препаратов.
Противобродильные и противогнилостные свойства. Минимальные количества С. кислоты останавливают брожение виноградного сахара, парализуя деятельность дрожжевого грибка. Раствор 1:1000 задерживает развитие плесени; раствор 1:3000 задерживает рост сибиреязвенных палочек; 1 часть С. кислоты на 1500 воды вызывает полную остановку в развитии бацилл сибирской язвы. В 0,4 % растворе предотвращается гнилостное разложение мяса. Несмотря, однако, на столь значительные антисептические свойства, С. кислота как обеззараживающее вещество имеет в медицине сравнительно малое применение, отчасти вследствие трудной растворимости, главным же образом, вследствие того, что она легко вступает в соединение с фосфорнокислыми и углекислыми солями, значительно теряя при этом свои дезинфицирующие свойства.
Влияние на температуру. С. кислота и ее натронная соль в терапевтических дозах не вызывает у здоровых людей понижения t° тела, у лихорадящих же, в зависимости от формы заболевания — значительно понижает повышенную температуру. Понижение особенно резко выступает при остром суставном ревматизме. Падение температуры под влиянием этих средств зависит от увеличенной теплоотдачи благодаря расширению сосудов и обильному потоотделению, но возможно, что такое действие отчасти обусловливается также уменьшением окислительных процессов в теле. Значительное понижение t° при остром суставном ревматизме не может быть объяснено исключительно процессами образования и потери тепла, так как такого понижения не наблюдается в других лихорадочных формах. Очевидно, что при остром ревматизме С. кислота устраняет самую причину, вызвавшую чрезмерное нагревание тела. Опыты на животных показывают, что С. кислота и ее натронная соль в умеренных дозах оказывают весьма слабое влияние на центральную нервную систему, равно также на периферические окончания чувствительных нервных волокон. Явления угнетения нервной системы наблюдаются только после применения токсических доз. Наблюдения над здоровыми людьми подтверждают экспериментальные исследования над животными. Но при остром суставном ревматизме С. кислота весьма резко уменьшает болезненность в суставах настолько, что больной, вынужденный соблюдать самый строгий покой из-за боязни сильной болезненности, после приема С. кислоты может без посторонней помощи принять то или другое положение в постели. Применение С. кислоты послужило толчком к введению во врачебную практику весьма важных жаропонижающих и болеутоляющих средств, благодаря которым современная терапия может во многих случаях обойтись без назначения различных отвлекающих средств, каковы банки, пиявки, горчичники, мушки, нарывные мази и др. С. кислота при внутреннем употреблении вызывает довольно сильное раздражение слизистых оболочек пищеварительного канала, поэтому ее обыкновенно заменяют более растворимой и менее раздражающей натронной солью. Ее назначают по 0,25 — 0,50 — 1,0 несколько раз в день в порошках или в растворе при суставном ревматизме, при серозном плеврите, против инфлуэнцы и гриппа, иногда при подагре и желчной колике. С. кислота применяется почти исключительно снаружи, в смеси с каким-нибудь жиром или вазелином (1 ч. на 10 ч. жира), в виде мазей, напр. при мокнущей экземе; в смеси с 90 % крахмала и 5 % талька — как присыпка против потливости ног; для пропитывания перевязочных материалов (3—10 % вата, марли или юта); в растворах (1:1000) для промываний ран, гнойных полостей. С. кислота и С. натрий, всасываясь со слизистых оболочек и поверхностей ран, нередко вызывали тяжелые побочные явления, всего чаще со стороны почек, через которые выводится большая часть введенных в организм С. препаратов. Поэтому при воспалительных явлениях в почках средства эти назначаются только в крайних случаях. При слабой деятельности сердца также необходимо быть осторожным, в особенности с назначением больших доз. Воспалительные явления среднего уха могут служить противопоказанием к назначению С. препаратов, так как последние, вызывая расширение сосудов, могут обусловить появление кровоизлияния в барабанной полости.
Д. Каменский.
Большая Советская энциклопедия
о-оксибензойная кислота, простейшая ароматическая оксикислота; бесцветные кристаллы, плохо растворимые в воде, хорошо — в органических растворителях; tпл 159 °с, tkип 211 °С (2,66 кн/м2).С. к. широко распространена в природе, главным образом в виде гликозида её метилового эфира (метилсалицилата). В промышленности её обычно получают карбоксилированием фенола (Кольбе - Шмитта реакция). С. к. обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами. Применяют наружно в мазях, пастах, присыпках и растворах при лечении кожных заболеваний; входит в состав Лассара пасты (См. Лассара паста), присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь». Натриевую соль С. к. (салицилат натрия), её амид (салициламид) и ацетилсалициловую кислоту (См. Ацетилсалициловая кислота) (аспирин) используют как жаропонижающие, противоревматические, противовоспалительные и болеутоляющие средства; фениловый эфир С. к. — как антисептик,
n-аминосалициловую кислоту (ПАСК) — как противотуберкулёзное средство. Благодаря антисептическому действию (см. Антисептические средства) С. к. употребляют при консервировании пищевых продуктов; её используют также в производстве азокрасителей, душистых веществ (эфиров С. к.), для колориметрических определения Fe и Cu, для отделения тория от других элементов.
Большой энциклопедический словарь
САЛИЦИЛОВАЯ КИСЛОТА (орто-гидроксибензойная кислота) - С6Н4(ОН)СООН; бесцветные кристаллы, tпл159 .С. Применяют в производстве красителей, лекарственных и душистых веществ, в пищевой промышленности (при консервировании), медицине (как наружное средство антисептического, раздражающего, кератолитического действия), как аналитический реагент.
Большой англо-русский и русско-английский словарь
salicylic acid
Англо-русский словарь технических терминов
salicylic acid
Научно-технический энциклопедический словарь
САЛИЦИЛОВАЯ КИСЛОТА (1-гидроксибензольная кислота, С7Н6О3), бесцветное вещество в виде кристаллов, производные которого используются в качестве анальгетиков (включая АСПИРИН, ацетилсалициловую кислоту), антисептиков, красителей и жидких мазей (линиментов). Встречается в природе в растениях, например, в коре ивы и масле зимолюбки.
Биологический энциклопедический словарь
САЛИЦИЛОВАЯ КИСЛОТА
ароматич. оксикарбоновая к-та. В природе встречается в свободном виде (в корнях истода сенеги, цветках ромашки, нек-рых плодах) и в форме гликозидов и эфиров гликозидов СООН (в эфирных маслах). Синтезируется растениями из бензойной к-ты. Антисептик. Натриевая соль С. к., её амид и ацетилсалициловая к-та (аспирин) — лекарств, препараты.
 Химическая энциклопедия
Химическая энциклопедия
(2-гидроксибензойная к-та), мол. м. 138,12; бесцв. кристаллы; т. пл, 159,5 °С, т. кип. 211 °С/20 ммрт. ст.; 1,443; рК,2,7, рK2 7,5. Легко раств. в этаноле, диэтиловом эфире, плохо-в CS2; р-римость в воде, г/л: 0,8 (0°С), 1,8 (20 °С), 8,2 (60 С С), 20,5 (80 °С). С. к.-одна из наиб. распространенных оксибензойных кислот. Образует по функц. группам два ряда производных. Хлорангидридами и ангидридами к-т ацилируется по гидроксигруппе; напр., под действием ацетилхлорида превращ. в ацетилсалициловую кислоту (аспирин). Действие РОСl3 на смесь С. к. и фенола приводит к сложным эфирам, взаимод. с анилином в присут. РСl3 -к салициланилиду:
1,443; рК,2,7, рK2 7,5. Легко раств. в этаноле, диэтиловом эфире, плохо-в CS2; р-римость в воде, г/л: 0,8 (0°С), 1,8 (20 °С), 8,2 (60 С С), 20,5 (80 °С). С. к.-одна из наиб. распространенных оксибензойных кислот. Образует по функц. группам два ряда производных. Хлорангидридами и ангидридами к-т ацилируется по гидроксигруппе; напр., под действием ацетилхлорида превращ. в ацетилсалициловую кислоту (аспирин). Действие РОСl3 на смесь С. к. и фенола приводит к сложным эфирам, взаимод. с анилином в присут. РСl3 -к салициланилиду:


Гидрирование С. к. на Pt с послед. гидролизом, а также восстановление Na в изоамиловом спирте протекает с образованием пимелиновой к-ты, напр.:

В природе С. к. встречается в растениях гл. обр. в виде гликозида ее метилового эфира.
Осн. пром. способ синтеза С. к. и ее производных -карбок-силирование сухого фенолята Na ( Кольбе-Шмитта реакция) действием СО 2 при давлении 0,6 МПа, т-ре 185°С в течение 8-10 ч.
Для качеств, определения С. к. используют р-цию с водным р-ром CuSO4 (зеленое окрашивание) или р-ром FеС13 (фиолетовое окрашивание, переходящее в бурое при добавлении ацетата Na).
С. к.-антисептик, входит в состав мазей, паст, присыпок и р-ров для лечения кожных заболеваний (напр., "салициловый спирт", представляющий собой р-р С. к. в этаноле, паста Лассара, мозольная жидкость и др.). С. к. применяют также в качестве консерванта нек-рых пищ. продуктов, полупродукта в синтезе красителей и фунгицидов. Эфиры С. к.-салицилаты (см. табл.)-полупродукты в произ-ве душистых в-в. Салицилат Na, салициламид, ацетилсалициловая к-та-жаропонижающие, противовоспалит. и болеутоляющие ср-ва; фениловый эфир (салол)-антисептик, n-аминосалициловая к-та (ПАСК)-противотуберкулезное ср-во.

В аналит. химии С. к.-реагент для фотометрич. определения Fe и Си, экстракц. отделения Th от др. элементов; кислотно-основной люминесцентный индикатор (при рН 2,5-4,0 появляется синяя люминесценция); металлохромный индикатор для титриметрич. определения Fe(III) при рН 1,8-3,0 (исчезает фиолетовое окрашивание) и Ti(IV) при рН 2-3 (переход окраски от фиолетовой к бесцв.).
Лит.: Чекалин М. А., Пассет Б. В., Иоффе Б. А., Технология органических красителей и промежуточных продуктов, 2 изд., Л., 1980, с. 274; Kirk-Othmer encyclopedia, 3 ed., v. 20, N. Y, 1968, p. 500-16; Ullmanns Encyklopa-die, 4 Aufl, Bd 7, Weinheim, 1974, S. 542. См. также лит. при ст. Оксибензойные кислоты. Г. И. Пуца.
Энциклопедический словарь
салици́ловая кислота́
бесцветные кристаллы, tпл 159°C. Применяют в производстве красителей, лекарственных и душистых веществ, в пищевой промышленности (при консервировании), медицине (как наружное средство антисептического, раздражающего, кератолитического действия), как аналитический реагент.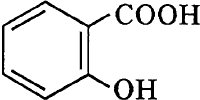
* * *
САЛИЦИЛОВАЯ КИСЛОТАСАЛИЦИ́ЛОВАЯ КИСЛОТА́ (орто-гидроксибензойная кислота), С6Н4(ОН)СООН; бесцветные кристаллы, tпл159 °С. Применяют в производстве красителей, лекарственных и душистых веществ, в пищевой промышленности (при консервировании), медицине (как наружное средство антисептического, раздражающего, кератолитического действия), как аналитический реагент.
Русско-английский политехнический словарь
salicylic acid
Dictionnaire technique russo-italien
acido salicilico
Естествознание. Энциклопедический словарь
бесцв. кристаллы, tnn 159 °С. В природе встречается в растениях гл. обр. в виде гликозида её метилового эфира. Применяют в произ-ве красителей, лекарств. и душистых в-в, в пищ. пром-сти (при консервировании), медицине (как наруж. средство антисептич., раздражающего, кератолитич. действия), как аналитич. реагент.

Большой Энциклопедический словарь
Большой Энциклопедический словарь. 2000.